Impfstoffe gegen COVID 19
– zugelassen, aber die Menge passt (noch) nicht –
Aktuelle Situation
Der lang ersehnte Impfstoff ist zugelassen und die ersten Impfungen haben bereits stattgefunden. Leider entspricht die derzeitig verfügbare Menge nicht dem Bedarf und Unmut macht sich breit. Die Forderung nach einer sofortigen Ausweitung der Produktion kam schnell und laut; Rufe nach einem Eingreifen des Staates um entsprechenden Druck auf die Unternehmen dahingehend auszuüben waren ebenfalls zu hören.
In diesem Beitrag möchte ich Hintergrundinformationen geben, warum die Produktion der Impfstoffe, insbesondere der neuartigen Impfstoffe auf RNA-Basis, nicht in kürzester Zeit beliebig erweitert werden kann.
Warum können die Unternehmen nicht schneller produzieren?
Es hat nichts mit dem Unwillen der Industrie zu tun, dass die Produktion nicht in der Geschwindigkeit wie von Öffentlichkeit und Politik gewünscht gesteigert werden kann, sondern mit den erforderlichen Produktionskapazitäten sowie den dazugehörigen Prozessen.
Die Unternehmen haben bereits vor der Zulassung unter Berücksichtigung der Vorbestellungen mit der Produktion begonnen, in der Hoffnung, dass ihr Präparat zeitnah die Zulassung erhält. Als das erste Präparat zugelassen war, war die Nachfrage sehr schnell größer als vorproduzierte und im ersten Schritt geplante Dosen zur Verfügung standen.
Was ist das Besondere an der Impfstoffproduktion?
Die Produktion von Impfstoffen ist eine der anspruchsvollsten innerhalb der Pharmazeutischen Industrie, denn sie muss unter aseptischen Bedingungen erfolgen. Das Produkt, der Impfstoff, kann nicht in seinem Glasgefäß, in das er zur Abfüllung gelangt, sterilisiert werden, so dass die Produktion selbst unter aseptischen Bedingungen erfolgen muss. Dies bedeutet, dass jeder einzelne Prozessschritt, der erforderlich ist, jedes Teil das benötigt wird, ebenfalls diese Kriterien erfüllen muss, damit die geforderte Asepsis sichergestellt werden kann. Die Anforderungen an den Herstellungsprozess sind hier demnach besonders hoch, da Mikroorganismen, Partikeln sowie Pyrogene ferngehalten werden müssen. Aus diesen Gründen kann die Produktion nur in sogenannten Reinräumen, die über eine entsprechende Filteranlage sowie eine dafür geeignete Produktionsstraße verfügen und entsprechend geschultes Personal vorweisen können, erfolgen.
Sowohl für die Anlage, auf der der Impfstoff produziert werden soll, als die für die zugehörigen Prozesse muss zweifelfrei nachgewiesen werden, dass sie für die Herstellung geeignet sind und auch immer das gleiche Ergebnis in konstanter Qualität liefern. Dies nennt man die Qualifizierung (Anlage) und Validierung (Prozess) und werden in der sogenannten „Guten Herstellungspraxis“ (GMP) beschrieben.
Sowohl die Qualifizierung der Anlagen als auch die Validierung der Prozesse müssen mit der entsprechenden Sorgfalt erfolgen und dürfen sich nicht von (Zeit-)Druck beeinflussen lassen. Andernfalls riskiert man, dass im ungünstigsten Fall eine Charge aufgrund eines Qualitätsmangels verworfen werden muss (Andreas Auer, GxP-Consulting). Das Ergebnis, Verlust der Rohware und ein damit einhergehender Lieferverzug wäre für alle Beteiligten unerfreulich, für den Hersteller und auch für uns, die wir auf den Impfstoff warten.
Die extremen Temperaturen und das sehr kurze Zeitfenster für die Produktion, das gerade für die neuartigen Impfstoffe gilt, ist eine sehr große Herausforderung, der sich sowohl die Unternehmen als auch deren Fachkräfte stellen müssen, aber mit entsprechender Vorbereitung leistbar ist.
Produktionsstandort Deutschland
Deutschland verfügt über eine Vielzahl von Standorten, an denen unter aseptischen Bedingungen produziert werden kann und die nach einer gewissen Anpassung für die Produktion genutzt werden.
Eine Übersicht, wie viele Unternehmen aktuell in die Herstellung eines Impfstoffes involviert sind, liefert Ihnen die unterstehende die Grafik. Laut dem Verband Forschender Arzneimittelhersteller e.V. – vfa zählt Deutschland international zu den Ländern mit besonders vielen Projekten für Impfstoffe gegen Covid-19.
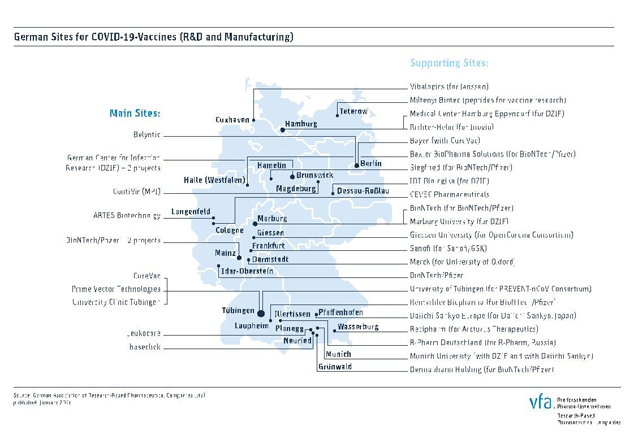
Ausblick
Wir müssen uns auch darüber im Klaren sein, dass diese Produktionskapazitäten, die jetzt für die Herstellung der COVID-19 Impfstoffe genutzt werden, für andere Arzneimittel, die ebenfalls aseptisch produziert werden müssen und häufig kritisch kranke Patienten betreffen, zunächst nicht mehr zur Verfügung stehen.
Zwar wird sich hier die Situation entspannen, wenn alle Impfwilligen mit Impfstoff versorgt sind, doch es müssen auch neue Anlagen müssen gebaut werden, um zukünftig Engpässe in der Produktion von sterilen Arzneimitteln zu vermeiden.
An einer Vielzahl von Standorten geschieht dies auch, stellt die Unternehmen jedoch wieder vor andere Herausforderungen wie z.B. Lieferzeiten von bis zu 12 Monaten für eine neue Anlage sowie dem derzeitigen Fachkräftemangel.
Fazit
Im Moment werden viele Hebel in Bewegung gesetzt, um der Gesellschaft in einem kurzen Zeitraum mehr Impfstoff zur Verfügung stellen zu können.
Die Liste der Unternehmen, die bei der Produktion der Impfstoffe hier in Deutschland unterstützen, ist lang. Produktionsstandorte werden ausgebaut oder neue aufgebaut, trotz alles Schwierigkeiten in Rekordzeit. Das Tempo, in dem dies geschieht, ist beeindruckend.
In Deutschland kann und wird im Laufe dieses Jahres genügend Impfstoff produziert werden, nicht nur für uns, sondern auch für andere.
Glossar
- Asepsis: Zustand der Keimfreiheit von operativen Instrumenten und Verbandstoffe
- Pyrogene: Bestandteile von z.B. Bakterien (Toxine) oder Viren, die bei parenteraler Gabe Fieber erzeugen können
- Parenteral: Aufnahme von Stoffen „am Darm vorbei“, d.h. direkt in den Blutkreislauf
- GMP: „Gute Herstellungspraxis für Arzneimittel“ („Good Manufacturing Practice“). Regelwerk zur Qualitätssicherung für die Produktion von Arzneimitteln
Zum Weiterlesen:
Aseptische Herstellung
Ausweitung der Produktion
Bild diese Beitrages mit freundlicher Genehmigung der Siegfried AG Zofingen




Seien Sie der erste, der einen Kommentar verfasst.